セロトニン
26 Dec 2016
セロトニンは 、ヒドロキシル化および脱カルボキシル化によってトリプトファンアミノ酸から形成される生体アミンです。 有意な量のセロトニンは、主に視床下部および中脳、胸腺細胞、ラボチッチ、肥満細胞、副腎中のより少ない量の腸の腸管マクロファージ様細胞(CNS)に含まれる。 セロトニンは、神経活動に影響を及ぼし、腸、子宮、気管支の円滑な筋肉の縮小を引き起こし、血管の狭小化も引き起こす。 セロトニンに対する生物の反応は、中枢性、筋萎縮性、神経節性、反射性の影響の基礎である。
教育。 セロトニン(5-gidroksi-triptamin、5-HT)は、L-トリプトファンからの腸炎菌腸上皮細胞において合成される。 セロトニンは、mezenterialny plexusの神経細胞およびメディエーターの役割を果たすCNSにおいても形成される。 血小板はセロトニンを合成しないが、それを取り込んで蓄積する。
セロトニン受容体。 受容体にはいくつかの種類があります。 薬理学的観点から、受容体5-HT1および5-NT2ならびに5-HT3および5-HT4も重要である。 原則として、受容体はGタンパク質を介して働く。 受容体5-HT3は陽イオンチャネルを表す。
セロトニンの影響。 心臓血管系。 セロトニンが異なるタイプの受容体を介して多くの部位で効果(時には反対のことがある)を有するため、心血管系に対するセロトニンの影響は複雑である。 血管の壁の非筋肉に位置する5-HT2-retseptoryを介して、セロトニンは血管の狭窄を引き起こす。 同時に、セロトニンの間接的効果は、ABPの血管拡張およびうつ病につながる可能性がある:5-HT1A-再検査を通して、交感神経緊張の抑鬱につながる脳幹および末梢の交感神経ニューロンを遮断する; 血管内皮における5-HT1受容体の活性化は、血管拡張剤(前立腺痙攣、NO)の放出をもたらす。 血小板から放出されるセロトニンは、妊娠中の女性の血栓形成、止血および緊張増強病因のプロセスにおいて役割を果たす。
スマトリプタン(片頭痛に対する薬剤)はアゴニスト5-HT1Dおよび5-HT1B-レセプトロフである。 神経栄養因子の放出の遮断によって引き起こされる頭蓋血管の狭窄は、いわゆる「神経原性炎症」または血管の危機を導く。 同時に、冠状動脈の痙攣狭窄に拘束された乳房には、拘束感がある。 他の「トリプトン」は、ナラトリプタン、ゾルミトリプタン及びリザトリパンである。
消化管。 mezenterialny plexusまたはenterokhromaffinnykh細胞で形成されるセロトニンは、5-HT4- retseptoryへの影響によって蠕動および腸の分泌を刺激する。
セロトニン受容体による腸の運動性に対する薬理学的影響の試みはこれまでのところ無効であった。 しかし、作動薬5-HT4であるチザプリドは、腸の推進運動を増加させることができる。 この副作用は、アセタールの影響下でアセチルコリンの濃度の上昇を示すAtropinumによってブロックされる。 薬は一連の副作用を引き起こす。 それは、他の物質との様々な予期せぬ相互作用につながるSURZA4の関与により、機構上不活性化される。 Tsizapridは心地よいリズム(QT間隔の減少)を妨げる(重篤なものを含む)ため、薬物は適用されない。
中枢神経系。 セロトニン受容体は、CNSの様々な機能において重要な役割を果たす。
フルオキセチンは、リターンセロトニンの再取り込みを阻止する抗うつ薬である。 それは意欲をかなり高め、また食欲を低下させる。
シブトラミン、リターンニューロロンセロトニン再取り込みおよびノルアドレナリンの遮断薬; それは肥満の治療薬として適用されます。
オンダンセトロンは、坐剤の適用によって引き起こされる嘔吐時に表現された鎮吐効果を有する。 彼は5-HT3-retseptorovのアンタゴニストである。 オンダンセトロンの類似体は、トロピセトロンおよびグラニセトロンである。
酸や他のサイケデリア(psikhotomimetika)、例えばメスカリンやサイロシビンは、おそらく5-NT-retseptorovの活性化のために、幻覚、意識障害、恐怖を引き起こす。
セロトニンの影響
McMaster大学のスタッフは、セロトニンの一種である肥満の重要な遺伝子が発見された科学的研究の著者になりました。 セロトニンは「喜びのホルモン」であることはよく知られており、脳の発達は精神的安定性と気分を高めます。 しかし、カナダの研究者が説明するように、心地よい感情の原因となるセロトニンは、この接続の第一のタイプに属する。
「彼は行動の場面と合成の形の2つのタイプに分かれています。最初のタイプは脳に発達し、異なる感情に影響を与えます」 - 生物学者は説明しました。
第2のタイプでは、末梢セロトニンはこの物質に属し、肥満の発生が依存する褐色脂肪組織の活性を調節する。 また、好きなことができPankramin 。
茶色の脂肪は、血中の砂糖の減少を促進する成分、およびカロリーの燃焼およびそれらのエネルギー処理を促進する成分を含む。 人の体には、茶色の脂肪が落ち着いてケージがより活発である特定のゾーンがあり、人の姿がより調和しています。 カナダの研究者は、第2のタイプのセロトニンを抑制すると結論づけた。 褐色脂肪組織の細胞のかなりの代謝活性を増加させることが可能である。 彼女は、体を強制的に白い脂肪を燃焼させます - そして、それは高カロリーの食べ物が人によってどのように食べられるかにかかわらず起こります。
セロトニン受容体
セロトニンの効果は非常に様々です。 この物質はTsNSのメディエーターとして作用し、血管およびGITの平滑筋に影響を与え、恒常性のある血管トロンボチトールに参加します。分子クローニングの方法は、予想外に多数の構造および機能に基づいて4つのタイプに分類されるセロトニン受容体を明らかにした。 5-HT1-、5-HT2-および5-HT4- retseptoryがG-タンパク質に組み込まれ、これらのタンパク質および第2の中間体の対応する系は、様々な酵素の機能およびエフェクターケージの電気 - 化学的特性に影響を及ぼす。 反対に、5-HT3-再帰はイオンチャネルと結びついている。 ここでは、セロトニン受容体の刺激薬および遮断薬について検討します。 セロトニン受容体を別々のサブタイプで選択的に作用しているこれらの群の最新の医薬品は、組換え受容体の使用を伴う研究で受け入れられた。 困難な精神機能やその持続性、攻撃的な行動、不安、うつ、周期的な夢の覚醒などに影響を及ぼす手段の研究にも適用される実験モデルにも取り組みます。 別々のサブタイプの現代の選択的刺激因子であって、既に成功しているセロトニン受容体が、片頭痛および不安の場合に適用され、多数の胃腸侵害の場合の選択的遮断薬が適用される。 セロトニン作動性伝達に作用する手段によっても、セロトニンの生理作用に影響を及ぼすことが可能である。 したがって、セロトニンのリターン捕捉の阻害剤は、うつ病および不安の治療に有効な薬剤であった。
多くの生理学的および病理学的プロセスにおけるセロトニンの役割は疑念を生じさせないにもかかわらず、その適用のポイントおよび作用機序はひどく研究されている。 おそらく、そのような状況の一部は、受容体のセロトニン症の多様性によって引き起こされる。 最初に薬理学的方法でテープにしたこれらの受容体は、今日KDNKクローニングによって受け入れられている。 組換えセロトニン受容体は、セロトニンの効果の分子メカニズムの研究、およびこれらの受容体の別々のサブタイプに選択的に影響を及ぼす薬剤の探索にも使用される。 類似の薬剤の臨床使用の円は、より広くより広くなる。
歴史的な情報
1930年にエルスパマーは、インドール誘導体の汚れによって腸炎菌細胞の局在を研究し始めた。 そのような誘導体の最高濃度は、GITによって粘液でテープされた。 さらに血小板およびCNSのいくつかの部門があった(Erspamer、1966)。 Cleandendクリニックで働いていたPeydzhと共著者たちは、出血が止まり、その構造を解読する過程で血小板から放出された血管収縮物質を初めて放出した(Rapport et al。、1948)。 Paige a serotonin(Page、1976)によって命名されたこの物質は、Erspamerによって研究されたインドールの誘導体に現れた。 セロトニン(Uden-friend、1959)およびそのアンギオトニック特性(Sjoerdsma、1959)の合成および崩壊の方法の記述は、腸内マクロファン細胞からの腫瘍を有する患者におけるいわゆるカルチノイド症候群のどのような示唆に基づく仮説を立てることを可能にしたこの物質の増加した生産によって引き起こされる。 実際に、そのような患者はセロトニンの尿を毎日放出し、その代謝産物は数百ミリグラムに達することがあります。 この疾患のいくつかの症状は、セロトニンの効果のメカニズムをある程度示す。したがって、患者では、受容時に生じる酸と同様の精神病が発症する可能性があります。 動植物組織では、幻覚作用を有する物質がトリプタマイミーと同様に見出されることを考慮すると、チャラシノイド症候群の患者において類似の物質が形成され、精神病の症状を引き起こすと推測することが可能である。 哺乳動物の脳におけるセロトニンのメディエーター機能については、50年代半ばに示唆された(Brodie and Shore、1957)。
セロトニンの効果の分子メカニズムに関する最初のデータは、Fasciola hepaticaの肝臓での経験で得られた(Mansour、1979)。 セロトニンの影響下で、tsAMFの移動性と集中力が急激に上昇した。 それと、他の効果は酸によってブロックされた。 移動性の増加は、fosfofruktokinazaの制限酵素分解酵素のtsAMF依存性リン酸化によって引き起こされた。 しかしながら、哺乳類の受容体より肝臓、おそらくは他のものにおけるこれらの作用を媒介するセロトニン受容体は、セロトニンに対するアデニラチクラズと相互作用した。 セロトニンの作用メカニズムに関する最新の詳細なデータでは、それまでのところ受け入れられませんでした。
セロトニンはすでに進化の初期段階で植物や動物に出現しており、これらにはセロトニン受容体の豊富さが語られている(Peroutka and Howell、1994)。 これらのレセプターのクローニングは、それらの別々のサブタイプに関連して選択的であると考えられていた薬剤のいくつかは、実際にいくつかのサブタイプに関して高い親和性を有することを示した。研究の歴史とセロトニンの影響についての詳細は、Sjoerdsma and Palfreyman(1990)の記事を参照してください。
セロトニンの化学的性質
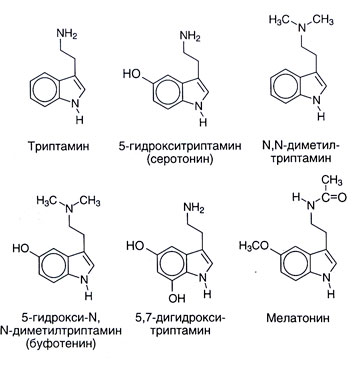
ソース。 セロトニンの化学構造およびそれとのいくつかの密接な関係が図1に示されている。 11.1。 セロトニンは、植物や動物の生活に広く分布しています。脊椎動物、チュニケート、軟体動物、軟体動物、節足動物、腸内膜、果実、ナッツなどで発見されています。 それは毒でも見られます - イラクサ、ワタ、サソリの中にあります。 セロトニンを実質的に変化させる多数の合成または天然の親族は、中枢および末梢の生理学的効果を有する。 多くのN-またはO-メチロバナインインドアミン(例えば、N、N-ジメチルトリタミン)は幻覚剤である。 彼らは生物の中で発達することができるので、長い間、精神病の少なくともいくつかの表示に責任があると考えられていました。 メラトニン(5-metoksi-N-atsetiltriptamin)は、その後のO-メチル化を伴うN-アセチル化によってセロトニンから形成される(図11.2)。 この物質は、その合成が外部要因(特に照射レベル)によって調節される体の主要なインドアミンとして働く。 メラトニンは皮膚のメラノ色素の色素脱失を引き起こし、卵巣の機能を抑制する。 おそらく、それはバイオリズムに関与しているため、タイムゾーンの変更のシンドロームに役立つ可能性があります。
合成と異化。 セロトニンは、2段階でトリプトファンの置換えられていないアミノ酸から形成される(図11.2)。 triptofangidroksilaza 5ヒドロキシトリプトファンの影響下の第一段階では、これは制限されたセロトニン合成反応である。 トリプトファンギドロキシラザは、混合された機能を有するオキシダーゼを表す。 分子酸素、および補酵素のテトラヒドロビオプテリンがそれによって触媒される反応に関与する。 triptofangidroksilazaおよびチロシンヒドロキシラーゼの活性は、リン酸化によって調節されるが、トリプトファンジドロシルシラザンは、負のフィードバックのメカニズムに関する最終産物によって阻害されない。 トリプトファンジドロシルスの脳では基質で飽和していないので、セロトニンの合成速度はトリプトファンの濃度に依存する。 最後は、いくつかの中性および枝分かれアミノ酸の輸送を担う担体によって、能動的に捕捉することによって脳細胞にもたらされる。 これに関して、脳におけるトリプトファンの維持は、血漿中のその濃度だけでなく、キャリアのためのトリプトファンと競合する他のアミノ酸の濃度にも依存する。
脱カルボキシル化は、5個のヒドロキシトリプトファンをセロトニンの形成に導く。 デカルボキシラーゼ5ヒドロキシトリプトファンおよびDOFAが異なるか、または同じ酵素であるかどうかに関する長い論争は、KDNKクローニング法によって解決されたが、同じ遺伝子産物が両方の基質の脱炭酸に関与することが判明した。 現在、この酵素は芳香族L-アミノ酸の脱炭酸酵素と呼ばれています。 これは非常に広範囲に及んでおり、多くの基材に影響を与えます。 5ヒドロキシトリプトファンは非常に迅速に脱カルボキシル化され、脳内ではほとんど検出されない。 これに関して、濃度変化によるセロトニン脳内の濃度に影響を及ぼす試みは、失敗する運命にある。
異化作用の主な方法は、セロトニンを5-ヒドロキシインドール酢酸に変換することであり、これは2段階で進行している(図11.2)。 最初にMAOの影響下で、生物中の広範なアルデヒドデグリゲナザザ酵素の影響下で5-gidroksi-indolacetic acidに移行する5-ヒドロ - キシインドールアセトアルデヒドが形成される(わずかな量のヒドロキシインドールアセトアルデヒドがアルコール-5-グリコシトリプトホールに変わる)。 5-ヒドロキシインドール酢酸は脳から活性に除去される。 このプロセスは、非特異的な経上皮伝達プロペンの阻害剤で抑制される。 神経細胞では、セロトニンの全代謝産物のほぼ100%が5-ヒドロキシインドール酢酸の分泌量に相当するため、プロベネシド導入後の5-ヒドロキシインドール酢酸のレベルの上昇に伴い、脳におけるセロトニン回路の割合が推定される。 脳および他の臓器で形成される5-ヒドロキシインドール酢酸、また5-gidroksitriptolおよびグルクロニドの少量も尿で除去される。 成人での5-ヒドロキシインドール酢酸の毎日の摂取は、通常、2〜10mgになります。 より高い値 - カルチノイド症候群の信頼できる兆候。 この疾患でのセロトニン合成の急激な増加は多数のピリジニックヌクレオチドおよびトリプトファンを必要とし、したがってこのような患者では稀ではないニコチン酸およびトリプトファンの欠乏の兆候を必要とする。 エタノールはNADNの維持の上昇を引き起こし、5ヒドロキシインドールアセトアルデヒドの結果として異化作用の酸化的方法から回復する(図11.2)。
これらは、5-gidroksitriptofolの摂取を少し増加させ、5-ヒドロキシインドール酢酸の摂取をそれぞれ減少させる。
MAOの2つのアイソザイムがある:MAO AおよびMAO B最初に、それらは基質に対する親和性および阻害剤に対する感受性に基づいて分割された。 現在、両方のアイソザイムがクローン化されており、クローニングされた形態および天然形態の特性は同一である(Shih、1991; hl。10も参照のこと)。 MAO Aはセロトニンおよびノルアドレナリンに対する優先的親和性を有し、その選択的阻害剤はクロルギリンである。 MAO Bは、β-フェニール - エチラミンとベンジルアミンでより多く作用します。 MAO B選択的阻害剤セレギリン。ドーパミンおよびトリプタンに対する両アイソザイムの親和性は同一である。 神経系ケージは主にミトコンドリアの外膜上にMAO AおよびMAO Bの両方を含む。 セロトニンも高濃度で含有する血小板の主なアイソザイムはMAO Bを提供するので
セロトニンの異化の他の方法、例えば硫酸化およびAbout - またはN-メチル化もあると考えられていた。 最終的な旅は、特に内在性の向精神性物質5-ヒドロキシ-N、N-ジメトルトリプトミナ(bufotenina、図11.1)の形成につながる可能性がある。 しかし、他のメタロバナジウムインドアミン(N、N-ジメチルトリタミン、5-metoksi-N、N-dimetiltriptamin)は、幻覚特性をはるかに発現しており、精神病の病因におけるそれらの役割がより起こりやすい。
セロトニンの不活性化は、酵素分解だけでなく、リターンキャプチャによっても行われる。 セロトニン作動停止のシナプス前膜の外表面に位置する依存性担体であり、血小板の膜の外面がこの捕捉(血液からのセロトニンの抽出)を担う。 血小板では、セロトニンの補充作用の独特な方法です。セロトニンの合成酵素は存在しません。 モノアミンの他の担体と同様に、セロトニン担体もクローン化される(hl.12)。
セロトニン投与のポイント
生物におけるセロトニンの維持の大部分は、CNSにおけるメディエーターとしても機能するが、末梢組織の分泌物にまで落ちる。 Enterokhromaffinnykh細胞および血小板におけるその濃度は最も高い。 セロトニンは、GITの運動性の調節において重要な役割を果たす。
Enterokhromaffinny細胞。 これらの細胞はGITの粘液に沈着する。 特に十二指腸には多くのものがあります。 enterokhromaffinnykh細胞では、それはトリプトファンから合成され、セロトニンが集まり、また他の生物学的に活性な物質、例えばサブスタンスPおよびキニナが含有する。 GITには、セロトニンのある程度の基礎分泌があります。 この分泌は、機械的伸張(例えば、栄養または高張塩溶液に入ったとき)および迷走神経の動力繊維の退屈で増幅する。 多分、GITの運動性に対するセロトニンの刺激効果は、間接的な神経叢のニューロンへの影響によっても媒介される(Gershon、1991; hl。38も参照)。 カルチノイド症候群におけるセロトニンおよび他の生物学的に活性な薬剤の急激な増加分泌に続いて、対応する胃腸、心臓血管および神経障害が続く。 さらに、セロトニンの合成の増加は、ニコチン酸およびトリプトファンの欠乏をもたらし得る。
Thrombocytes。 血小板は、特にセロトニンを貯蔵および放出する能力において、血液の他の配合された要素とは異なる。 血小板におけるセロトニンの合成は起こらない。 セロトニンは血液から血小板に取り込まれ、能動輸送によって秘密の電子顆粒に貯蔵される。 これらのプロセスは、多くの点で、交感神経終結(hl.6および12)におけるノルアドレナリナムの捕捉および貯蔵に類似している。 血小板の膜を介して、セロトニンはNa +依存性輸送によって、そして顆粒には、N + -Atfazoyによって囲まれたH +の電気化学勾配のエネルギー源としての二次活性輸送によって移される。 同時に、顆粒中のセロトニンの濃度は0.6mol / lに達し、血小板の細胞質よりも1000倍高い。 セロトニン再取り込みの阻害剤の活性の敏感なインジケータを血小板による+依存性セロトニン再取り込みで評価する。
血小板の主な機能は止血であり、損傷した内皮の隙間を閉じる。 他方、内皮の完全性は、血小板の機能に重要な役割を果たす(Furchgott and Vanhoutte、1989)。 内皮は、現在の血液中で作用するシフト力が血管の周辺に移動するため、血小板に常に接触する(Gibbons and Dzau、1994)。 A2のセロトニンとトロンボキサンの血管収縮作用は、血管弛緩の内皮因子(おそらく、いくつかの他の物質)によって抵抗される(Furchgott and Vanhoutte、1989;図11.4)。 血小板の接着および凝集のためには、内皮の状態が極めて重要である(Hawiger、1992; Ware and Heistad、L993)。 血小板が損傷した内皮に隣接すると、それらは物質を放出して、それらの接着およびセロトニン放出を引き起こす。 ADFとòðîìáîêñàíA2はそのような物質に属している(hl。26と55)。 セロトニンと5-HT2A-レセプターラミの結合は、コラーゲンの存在下で急激に増幅する弱いプロゲレジント効果を有する。 血管壁の欠損が平滑筋層に達すると、セロトニンは止血メカニズムの1つとして作用する直接的な血管収縮作用をもたらす。 この効果は、A2、キニン、血管作用性ペプチドのトロンボキサンの損傷の分野で放出される生物学的に活性な薬剤の影響下で増幅される。 アテローム性動脈硬化症における血栓の形成は、内皮の破壊、および結果として血管弛緩の内皮因子の欠如によって促進される。 このような状況では、血栓形成に至るプロセスは、悪循環として制御されずに進行する。 それらの一部はセロトニンによっても遊ばれる。 同様の画像は、例えばReynaud症候群および血管痙攣性の心筋梗塞などの他の病気でも観察することができる。
図3の説明を参照されたい。 11.4。 血小板のセロトニンの機能 血小板からのセロトニンの放出は、それらを接着および凝集によって開始する。 次に、セロトニンは、1)内&

 カート
カート